Обращение медицинских изделий по правилам ЕАЭС

Сразу после создания Евразийского экономического союза (далее – ЕАЭС) в мае 2014 началось активное формирование общего рынка медицинских изделий (далее – медизделий, МИ) на территориях РФ, республик Армении, Беларусь, Казахстан, Киргизии. В настоящей статье Факультет Медицинского Права излагает общую информацию об обращении медизделий в государствах-членах ЕАЭС, правилах их регистрации, единой номенклатуре и отличительном знаке, который идентифицирует принадлежность медицинского изделия общему рынку ЕАЭС. Обо всем по порядку и начнем с небольшого экскурса в политику.
- Государственная политика в сфере обращения МИ
- Общий рынок медизделий ЕАЭС
- Переходный период: с 01.01.2016 до 31.12.2021
- Когда регистрация МИ по правилам ЕАЭС станет обязательной?
- Ввоз медизделий в ЕАЭС
- Номенклатура медицинских изделий ЕАЭС
- Как отличить медизделие, обращающееся в рамках ЕАЭС?
- Помощь Факультета медицинского права
Государственная политика в сфере обращения МИ
Одной из главных задач образования и существования ЕАЭС выступает создание единого рынка стран-участниц, в рамках которого свободно перемещаются товары по одним правилам, в том числе медицинские изделия. Для производителей и продавцов медизделий это означает, что медизделия, зарегистрированные в Москве, можно продавать в Минске, в Алмате, в Ереване, в общем в любом месте на всей территории государств-участников ЕАЭС. Очевидно, что это, с одной стороны, расширяет экономические перспективы для всех участников рынка, а с другой, определяет и общие направления правового регулирования.
Напомним, что основы правовых рамок существования ЕАЭС заложены в Договоре о Евразийском экономическом союзе, подписанном в г. Астане 29.05.2014 (далее – Договор). Ключевым документом, касающимся медицинских изделий, является Соглашение о единых принципах и правилах обращения медизделий (изделий медицинского назначения и медицинской техники) в рамках ЕАЭС, заключенное в г. Москве 23.12.2014 и подписанное Распоряжением Правительства РФ от 19.12.2014 № 2629-р (далее – Соглашение).
Согласно ст. 3 Соглашения скоординированная политика государств-членов ЕАЭС обеспечивается посредством:
- принятия мер, необходимых для гармонизации законодательства государств – членов в сфере обращения МИ;
- установления общих требований безопасности и эффективности МИ на территории Союза;
- установления единых правил обращения МИ в соответствии с рекомендациями Международного форума регуляторов медицинских изделий (IMDRF);
- определения единых подходов к созданию системы обеспечения качества МИ;
- гармонизации номенклатуры МИ, используемой в государствах–членах, с Глобальной номенклатурой медицинских изделий (Global Medical Device Nomenclature);
- гармонизации законодательства государств–членов в части установления ответственности за нарушение требований в сфере обращения МИ.
Таким образом, правовое регулирование медизделий на территории ЕАЭС учитывает и международные нормы права, и межнациональные нормы, которые вырабатываются при участии всех стран, составляющих ЕАЭС.
При этом эффективность правового регулирования обращения медицинских изделий в ЕАЭС обеспечивается за счет:
- единых требований к регистрации МИ, произведенных в ЕАЭС и ввезенных на его таможенную территорию;
- взаимного признания результатов исследований (испытаний) и экспертиз, полученных в ходе процедур регистрации МИ, при условии их выполнения в соответствии с утвержденными ЕЭК требованиями;
- формирования общей информационной системы в сфере обращения МИ: единого реестра зарегистрированных МИ, единого реестра организаций, имеющих право на проведение испытаний МИ в целях их регистрации, единой базы данных мониторинга безопасности, качества и эффективности МИ;
- маркировки медизделий специальным знаком ЕАЭС.
Общий рынок медизделий ЕАЭС
Формирование общего рынка медицинских изделий (изделий медицинского назначения и медицинской техники) предусматривается ст. 31 Договора. Согласно этой статье принципами создания такого рынка декларируются:
- гармонизация требований законодательства государств-членов в сфере обращения медизделий (изделий медицинского назначения и медицинской техники);
- обеспечение единства обязательных требований к эффективности и безопасности МИ (изделий медицинского назначения и медицинской техники), находящихся в обращении на территории ЕАЭС;
- принятие единых правил в сфере обращения МИ (изделий медицинского назначения и медицинской техники);
- определение единых подходов к созданию системы обеспечения качества МИ (изделий медицинского назначения и медицинской техники);
- гармонизация законодательства государств-членов в области контроля (надзора) в сфере обращения МИ (изделий медицинского назначения и медицинской техники).
Проще говоря, в РФ, Армении, Казахстане, Киргизии и Беларуси будут действовать одни и те же правила обращения медицинских изделий, в том числе обязательные требования к эффективности и безопасности МИ, единые подходы к созданию системы обеспечения качества МИ, общие правила в области контроля (надзора) в сфере обращения МИ.
Согласно ст. 100 Договора функционирование общего рынка МИ началось с 1 января 2016 года.
Открытая официальная информация об общем рынке медицинских изделий в ЕАЭС доступна на официальном портале общих информационных ресурсов и открытых данных ЕАЭС здесь. На странице «Общий рынок медицинских изделий» доступны информационные ресурсы, например, единый реестр медицинских изделий, зарегистрированных в рамках ЕАЭС, информационные сервисы, нормативные документы, нормативно-справочная информация, а также перечень уполномоченных органов и организаций в сфере рынка медизделий ЕАЭС.
Переходный период: с 01.01.2016 до 31.12.2021
Основной предпосылкой создания общего рынка медицинских изделий является унификация правил их регистрации. Правила регистрации медизделий в рамках ЕАЭС установлены в Решении Совета Евразийской экономической комиссии от 12.02.2016 № 46 «О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий» (далее – Правила). Подробнее о них читайте в статье «Правила регистрации медицинских изделий по законодательству ЕАЭС».
Вместе с тем, поскольку любое новое начинание требует времени, для создания общего рынка медизделий ЕАЭС предусмотрен переходный период, который регламентирован ст. 11 Соглашения.
| Статья 11 (первоначальная редакция) |
Статья 11 (в редакции Распоряжения Коллегии Евразийской экономической комиссии от 02.09.2019 № 142*) |
|---|---|
| Документы, подтверждающие факт государственной регистрации медицинских изделий и выданные уполномоченным органом до вступления настоящего Соглашения в силу, действуют на территории государства-члена до окончания срока их действия, но не позднее 31 декабря 2021 г. | До 31 декабря 2021 г. по выбору производителя медицинского изделия или его уполномоченного представителя регистрация медицинского изделия может осуществляться в порядке, устанавливаемом Комиссией, либо в порядке, предусмотренном законодательством государства-члена.
Медицинское изделие, зарегистрированное до 31 декабря 2021 г. в порядке, предусмотренном законодательством государства-члена, может быть перерегистрировано до 31 декабря 2026 г. в порядке, предусмотренном законодательством этого государства-члена, и может обращаться на территории этого государства-члена до окончания срока действия документов, подтверждающих факт государственной регистрации такого медицинского изделия, с правом внесения изменений в регистрационные документы. |
*В соответствии со ст. 2 Распоряжения «настоящий Протокол вступает в силу с даты получения депозитарием по дипломатическим каналам последнего письменного уведомления о выполнении государствами-членами внутригосударственных процедур, необходимых для вступления настоящего Протокола в силу». Данные о подписании государствами-членами ЕАЭС проекта Протокола о внесении изменения в Соглашение выявить не удалось, а значит исходим из того, что на сегодняшний день ст. 11 Соглашения действует в первоначальной редакции.
Таким образом, вопрос сохранения в силе после 31.12.2021 действующих регистрационных удостоверений, выданных по «национальной» процедуре регистрации медицинских изделий, а также ВИРДы по ним, остается открытым и нерешенным. В связи с этим в этой части ожидаем какое-нибудь нормативно-правовое регулирование.
Сейчас1 на рассмотрении Государственной Думы РФ находится проект Федерального закона № 1080292-7 «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам обращения медицинских изделий». На текущий момент проект предлагает дополнить ст. 38 Федерального закона от 21.11.2011 № 323-ФЗ (ред. от 08.12.2020) «Об основах охраны здоровья граждан в Российской Федерации» частями 3.1 и 3.2 следующего содержания:
«3.1. Допускаются предусмотренные технической и (или) эксплуатационной документацией производителя (изготовителя) транспортировка, монтаж, наладка, настройка, калибровка и иные действия, необходимые для ввода медицинского изделия в эксплуатацию, применение, эксплуатация, в том числе техническое обслуживание и ремонт медицинского изделия, по окончании срока действия регистрационного удостоверения на это медицинское изделие, если срок службы (срок годности) медицинского изделия не истек.
3.2. До истечения срока службы (срока годности) медицинских изделий допускается обращение таких изделий, в том числе произведенных в течение ста восьмидесяти календарных дней после дня принятия уполномоченным федеральным органом исполнительной власти решения о внесении изменений в документы, содержащиеся в регистрационном досье на медицинское изделие, в соответствии с информацией, содержащейся в таких документах до дня принятия указанного решения».
То есть законодатель ввиду неопределенности в вопросе действующей редакции ст. 11 Соглашения предлагает разрешить эксплуатацию ранее зарегистрированных медицинских изделий, срок службы (годности) которых не истек. О том, станет ли это правило нормой закона или нет, сообщим дополнительно.
Когда регистрация МИ по правилам ЕАЭС станет обязательной?
С 1 января 2022 первичная регистрация медицинских изделий будет осуществляться исключительно по единым правилам ЕАЭС. При этом как разъясняет Росздравнадзор России (РЗН) возможность прохождения упрощенной процедуры регистрации медизделия, зарегистрированного в соответствии с национальным законодательством, законодательством ЕАЭС в сфере обращения медицинских изделий, в том числе Правилами регистрации и экспертизы безопасности, качества и эффективности медицинских изделий, утвержденными Решением Совета Евразийской экономической комиссии от 12.02.2016 № 46, не предусмотрена.
Подробно о порядке регистрации медизделия по законодательству ЕАЭС мы рассказываем в статьях раздела «Государственная регистрация медицинских изделий в рамках ЕАЭС».
О том, как происходит государственная регистрация медицинских изделий по законодательству России можно прочесть в разделе «Государственная регистрация медицинских изделий в рамках национальной системы».
Ввоз медизделий в ЕАЭС
В соответствии с п. 4 Правил регистрация и экспертиза медицинского изделия являются обязательными условиями его выпуска в обращение в рамках ЕАЭС и осуществляются уполномоченным органом референтного государства. При этом предъявляются одинаковые требования в отношении медицинских изделий, произведенных на территории Союза и ввезенных на таможенную территорию Союза из третьих государств. Учитывая то, что порядок ввоза незарегистрированных медизделий на территорию ЕАЭС в целях их регистрации никак не регламентирован, правила ввоза МИ в отдельных случаях лучше уточнить непосредственно в РЗН. Письменный ответ РЗН так или иначе обеспечит хотя бы «спокойствие души».
Кстати, законопроект, о котором мы сказали чуть выше, предусматривает необходимость получения разрешения РЗН на ввоз незарегистрированного в ЕАЭС медицинского изделия, для оказания медицинской помощи по жизненным показаниям конкретного пациента.
Номенклатура медицинских изделий ЕАЭС
Функционирование общего рынка медизделий базируется на общих понятиях, о которых всегда проще договориться «на берегу». Итак, номенклатура медицинских изделий ЕАЭС – систематизированный номенклатурный классификатор видов медицинских изделий, гармонизированный с Глобальной номенклатурой медицинских изделий и применяемый в рамках ЕАЭС.
Номенклатура медизделий ЕАЭС содержит перечень видов медицинских изделий с указанием номенклатурных наименований, уникальных кодов и описаний видов медицинских изделий, включающих классификационные признаки медицинских изделий в зависимости от назначения медицинских изделий и (или) их устройства.
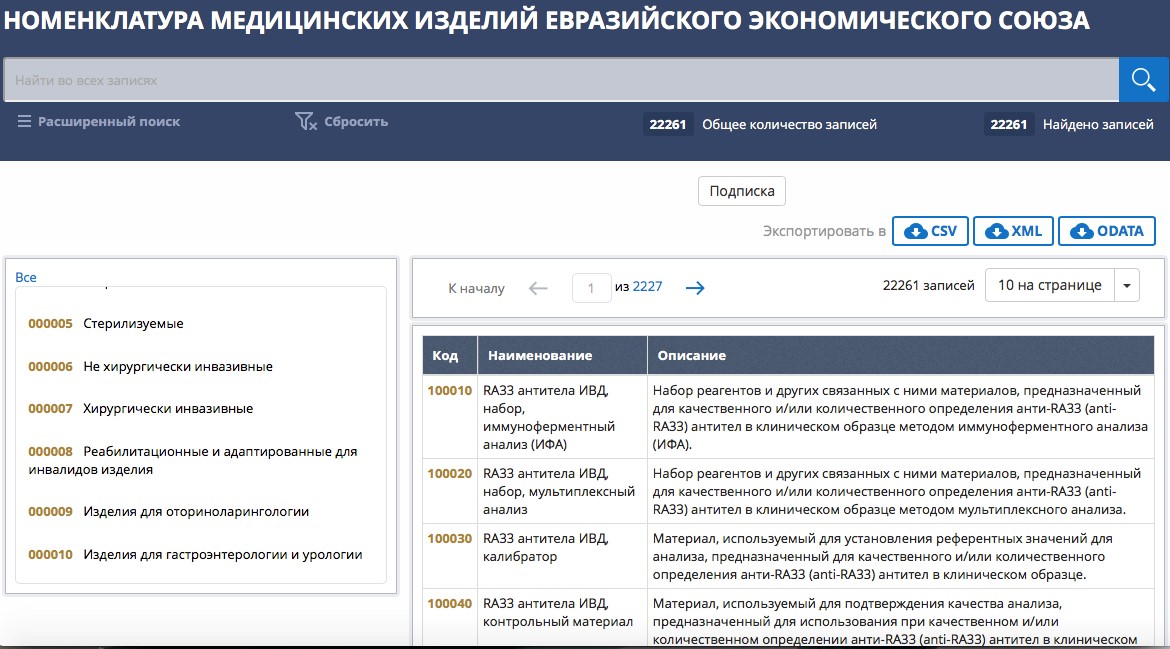
Официальные данные о номенклатуре доступны здесь.
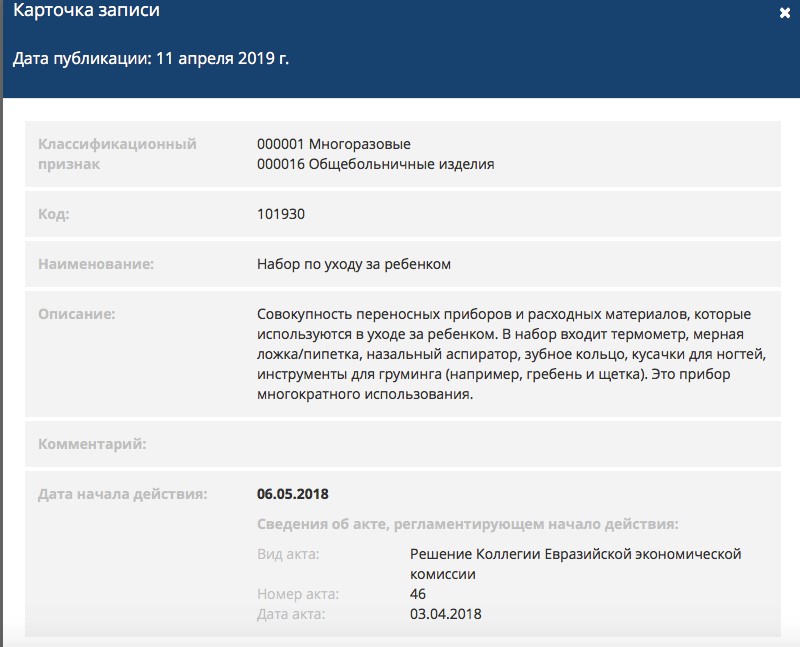
Стандарт карточки записи выглядит так:
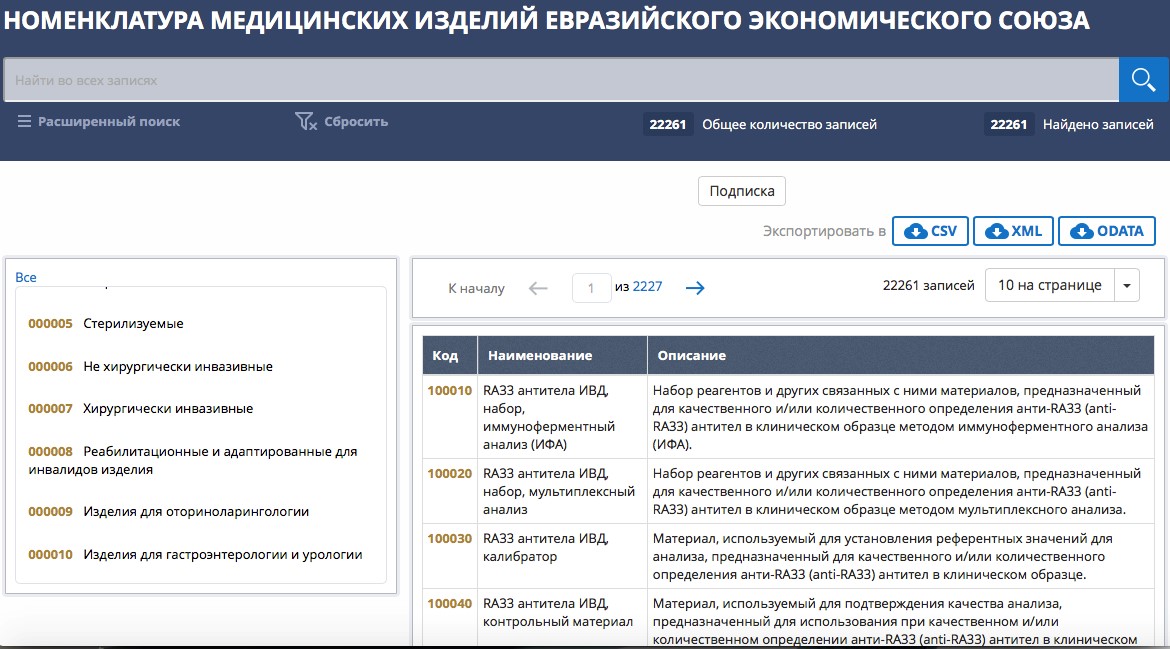
Через информационные ресурсы ЕАЭС можно искать медицинские изделия по 19 разделам, сформированным по сферам их применения (начиная от анестезиологических и респираторных МИ и заканчивая эндоскопическими МИ). Визуально этот сервис выглядит так:
В разделе можно выбрать нужное медизделие, после «клика» на которое, справа будет открыто его описание с указанием номенклатурного кода.
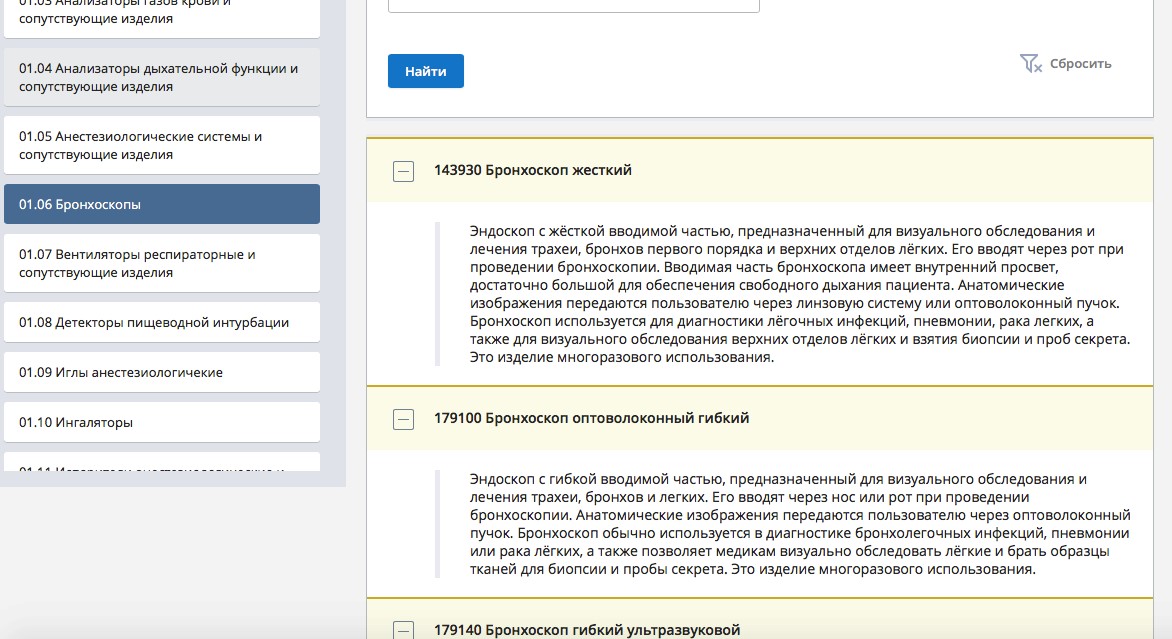
Активная ссылка здесь.
Согласно решению Коллегии ЕЭК от 03.04.2018 г. № 46 «О номенклатуре медицинских изделий Евразийского экономического союза» использование кодовых обозначений номенклатуры является обязательным при реализации общих процессов в рамках ЕАЭС в сфере обращения медицинских изделий. Поэтому использование номенклатуры обязательно и при подготовке регистрационного досье. Подробнее об этом читайте в статье «Этапы регистрации медицинских изделий в рамках ЕАЭС».
Как отличить медизделие, обращающееся в рамках ЕАЭС?
К обращению медицинских изделий в рамках ЕАЭС допускаются изделия, зарегистрированные в соответствии с Правилами в референтном государстве и в тех государствах признания, уполномоченные органы (экспертные организации) которых подтвердили согласование экспертного заключения. Подробнее о процедуре регистрации читайте в статьях «Правила регистрации медицинских изделий по законодательству ЕАЭС», «Этапы регистрации медицинских изделий в рамках ЕАЭС».
Документом, подтверждающим факт регистрации, является регистрационное удостоверение. В едином реестре медицинских изделий, зарегистрированных на территории ЕАЭС, уполномоченным органом размещаются сведения о регистрации медицинского изделия, инструкция по медицинскому применению и изображение его маркировки. Для выпуска в обращение медицинские изделия в обязательном порядке маркируются специальным знаком:

Положение о специальном знаке обращения медицинских изделий на рынке ЕАЭС доступно по ссылке.
Помощь Факультета медицинского права
Факультет медицинского права оказывает следующий спектр услуг по сопровождению процесса регистрации медицинских изделий по законодательству ЕАЭС в Росздравнадзоре, если референтным государством для регистрации медицинского изделия выбрана Российская Федерация (как в комплексе, так и выборочно):
- Развернутые консультации, четкие инструкции при подготовке документов.
- Подготовка документов регистрационного досье.
- Организация проведения испытаний медицинского изделия на территории РФ, включая технические испытания, испытания (исследования) с целью оценки биологического действия медицинского изделия, испытания в целях утверждения типа средств измерений, а также клинические испытания.
- Сопровождение на всех этапах регистрации в Росздравнадзоре, включая стадию экспертизы качества, эффективности и безопасности медицинского изделия.
Подробнее о сопровождении процедуры регистрации медицинских изделий в рамках ЕАЭС.
Материал не учитывает изменения ФЗ № 323 после 01.05.2021. Их мы освещаем в статье «Изменения в законодательстве об обращении медицинских изделий».
- 1На дату 16.03.2021
Еще более 1750 статей.









