31 марта 2021
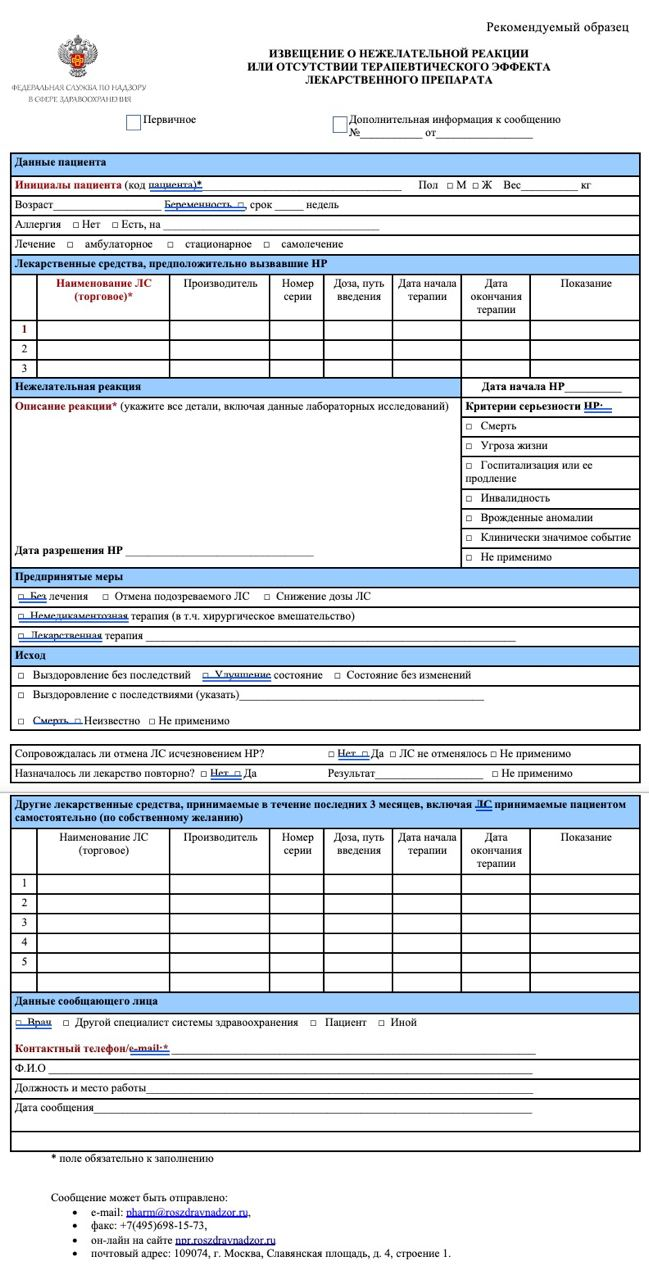
Порядок осуществления фармаконадзора
Автор: Юридический отдел «Факультета медицинского права»
2553
Доступ к платным сервисам kormed.ru
Для физ. лиц
Для юр. лиц
Отчетные документы не предоставляются
Есть вопросы? Запишитесь на консультацию!
Вам также будет интересно
579
Судебная практика
Трезв пациент или пьян, но отказ от медпомощи только письменный
436
Лекарства, медизделия и технологии
Хранение лекарственных средств по-новому
446
Ответственность и проверки
Обзор преступлений в сфере закупок, или Статьи в ассортименте
Самая широкая база знаний по медицинскому праву.
Еще более 1750 статей.
Еще более 1750 статей.