31 марта 2021
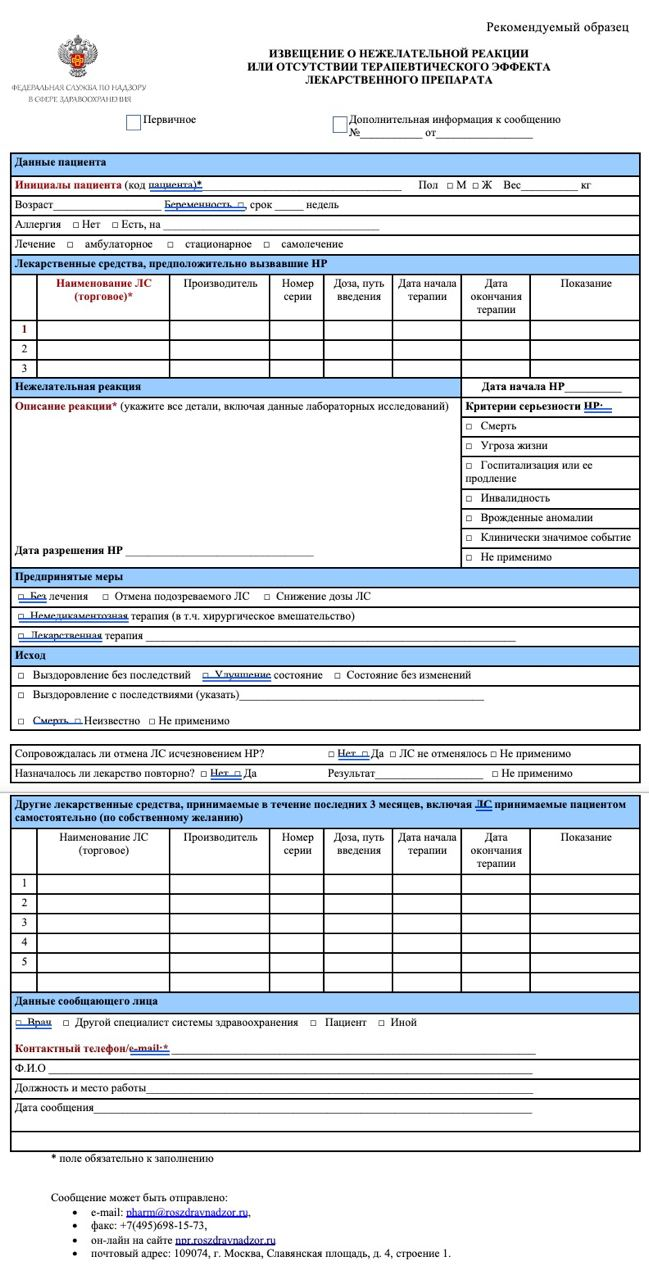
Порядок осуществления фармаконадзора
Автор: Юридический отдел «Факультета медицинского права»
2111
Доступ к платным сервисам kormed.ru
Для физ. лиц
Для юр. лиц
Отчетные документы не предоставляются
Есть вопросы? Задайте их юристу!
Вам также будет интересно
218
Претензии и иски пациентов
Когда клиника заплатит за травму пациента
282
Медицинские кадры
Штраф главврачу за задержку выплаты зарплаты работникам
589
Проверки органами надзора в сфере здравоохранения
Применение препаратов офф-лейбл – шаг к аннулированию лицензии?
Самая широкая база знаний по медицинскому праву.
Еще более 1750 статей.
Еще более 1750 статей.